オープンイノベーションは小野薬品の生命線。
AIを活用した創薬においても積極的にオープンイノベーションを推進することで、最先端技術を取り入れ、効率的に革新的な医薬品の創製に挑戦しています。
なぜAIを創薬に活用するのか?
新薬の開発には10年以上の時間と1,000億円以上の費用がかかり、成功率は4%に満たないと言われています※。AI創薬は、こうした極めて困難な状況にブレークスルーをもたらす可能性を秘めています。膨大な遺伝子データや化合物情報を短時間で解析し、有望な候補を見つけ出すほか、失敗リスクが高い候補や副作用の可能性を見極めることもできます。人間の記憶が「本棚ひとつ分」だとすれば、「巨大な図書館」とも言われるAI。その活用によって、開発期間を大幅に短縮し、成功率を向上させることが期待されています。
※ 出典:日本製薬工業協会「製薬協ニューズレター No.224」p17

小野薬品のAI創薬
当社は20年以上前から、計算化学やシミュレーションなどの技術を活用した研究に取り組んできました。オープンイノベーションを強みとし、製薬企業やハイテク企業をはじめとする多様なパートナーとの共創を積極的に進めています。
デジタル・AI創薬の歩み
| 1992年頃〜 | データの⼀元管理開始 |
|---|---|
| 2017年 | 最先端のシミュレーション技術をもつSchrödinger社との協業を開始 |
| 2018年頃~ | ⽣成AIの活⽤を検討開始 |
| 2020年 | Locus社との協業により「ベレキシブル」を上市 |
| 2021年 | Healx社との協業開始 |
| 2022年 | Iktos社との協業開始 |
オープンイノベーションを
活用したAI創薬
Tokyo-1プロジェクトへの参画
小野薬品は、国内製薬企業4社が連携して進める生成AI創薬プロジェクトに2023年から参画しています。本プロジェクトでは、大規模GPUスーパーコンピューター「Tokyo-1」を活用し、高性能な計算リソースを即時に利用できる環境を整備。これによって創薬研究の飛躍的な加速を見込んでいます。また、製薬企業各社が競合しない領域での企業間情報交換の仕組みも設けられており、オープンイノベーションによる知見の共有が、研究の質とスピードの向上に貢献すると期待しています。

小野薬品のAI創薬の最前線
創薬初期の有望な候補物質の発見から、医薬品としての開発候補の選定に至るまでの全工程でAI活用を推進し、創薬の効率化・高度化を図っています。

膨大な研究データをAIの力で徹底的に解析し、これまで見つけられなかった創薬シーズの発見や、より効率的な化合物設計を可能にすることで、開発期間の大幅な短縮と成功確率の飛躍的な向上を目指しています。しかし、私たちが目指すのは単なる効率化ではありません。AIに任せるべきことと、人間だからこそ発揮できる創造性や情熱――その最適なバランスを見極めることこそが、真のイノベーションを生み出す鍵だと信じています。AIと人の知恵を融合させ、創薬という挑戦のプロセスそのものを進化させる。私たちは、すべての患者さんの「明日」を切り拓くために、熱い情熱と責任を胸に、歩みを止めることなく挑戦し続けます。
研究本部 創薬ケミストリー研究部⻑
江頭 啓
創薬研究におけるAI活用の全体像
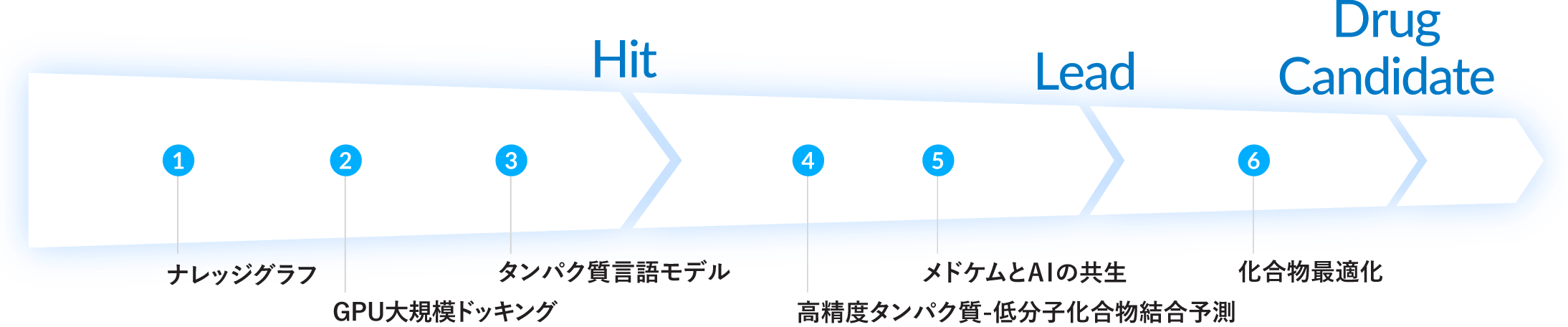
Hit(ヒット化合物):標的となるタンパク質に対する活性が確認された、創薬初期の化合物。
Lead(リード化合物):ヒット化合物の中から、活性や選択性、安全性などを改善することで、新薬候補としての特性がより高められた化合物。
Drug Candidate(新薬候補化合物):前臨床試験に進むために選定された化合物。安全性や有効性などの基準を満たしており、実際の医薬品開発対象となる段階。
1 ナレッジグラフ
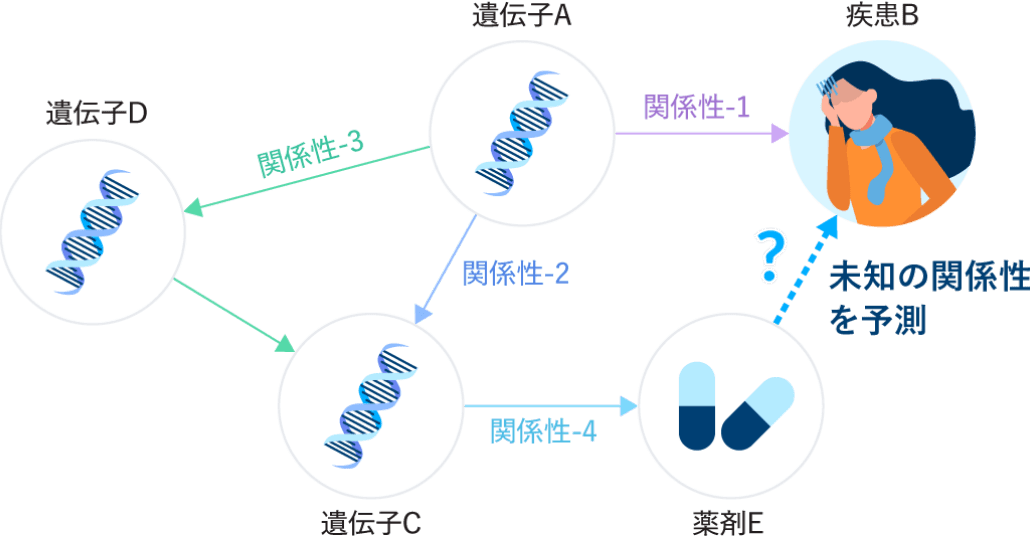
当社は、創薬における予測や仮説生成を目的に、AIとナレッジグラフを組み合わせた先進的手法を導入。遺伝子や疾患、薬剤などの関係性を構造化し、有用な知見を抽出しています。膨大な計算処理にはTokyo-1を活用し、現実的な時間で高度な解析を実現。Healx社との連携やオープンソースの活用で得られた成果を踏まえ、独自モデルの構築も進行中です。さらに、XAI(説明可能な人工知能)や大規模言語モデルの導入、社内データの統合にも取り組み、創薬の質とスピードの両立を目指しています。
2 GPU大規模ドッキング
Tokyo-1の合同分科会では、GPUを活用した超高速SBVS(構造ベース仮想スクリーニング)に複数の製薬企業共同で取り組んでいます。低分子化合物の前処理プログラムと高速化ツールの開発により、一般的な手法の100倍以上の処理速度を実現。各社で700万化合物の解析を数日で完了させるなど成果が出ています。現時点では困難な1,000億化合物規模のスクリーニングについても、AIとの連携によって数日で処理可能なプロセスの構築を目指しています。

3 タンパク質言語モデル
公開されている様々なタンパク質言語モデルや抗体言語モデルを活用することで、抗体パラメータ予測や活性向上改変に取り組んでいます。Tokyo-1により膨⼤な計算処理を実⾏し、試験的に設計した数十種の抗体の中には、結合活性が最大で30倍改善されたものも含まれていました。現在はタンパク質言語モデルの基盤モデルに抗体データを学習させることで、より高精度な予測ができるモデルの構築を目指しています。

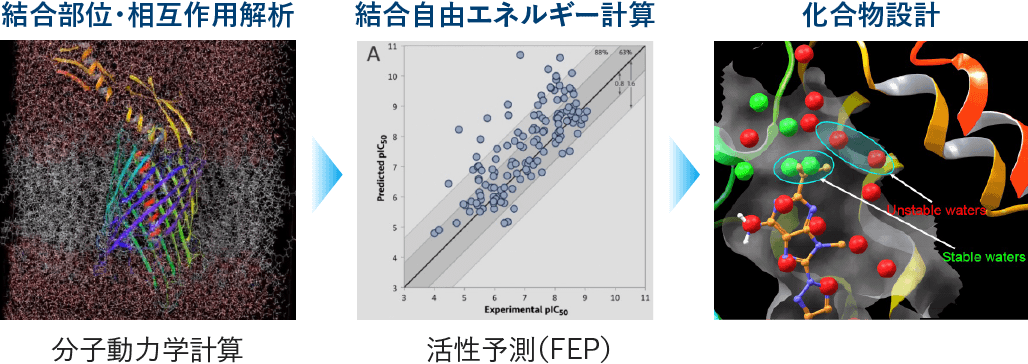
4 高精度タンパク質-低分子化合物結合予測
当社では、創薬における構造ベースのアプローチとして、タンパク質の立体構造をX線結晶構造解析やクライオ電子顕微鏡、AI技術を活用して取得しています。得られた構造情報をもとに、分子動力学計算でタンパク質と低分子化合物の結合様式や相互作用を詳細に解析。さらに、FEP+(自由エネルギー摂動法)により結合自由エネルギーを算出し、化合物の結合の強さを高精度に予測します。これらの結果を新たな化合物の設計や候補の最適化に活用し、創薬研究の効率化を図っています。
5 メドケムとAIの共生
創薬化学研究者(メディシナルケミスト、以下メドケム)とAIが協働する「ソーシャル創薬」を推進。メドケムの知見とAIの知性を融合させ、分子設計の課題解決を目指しています。スーパーコンピューター「Tokyo-1」を活用し、メドケムのフィードバックをもとにAIの強化学習を実施。現在、メドケム版AIエージェントの開発やメドケムとAIエージェントのインタラクションテストを進めており、人間とAIが共に進化する協働システムの実装を加速していきます。
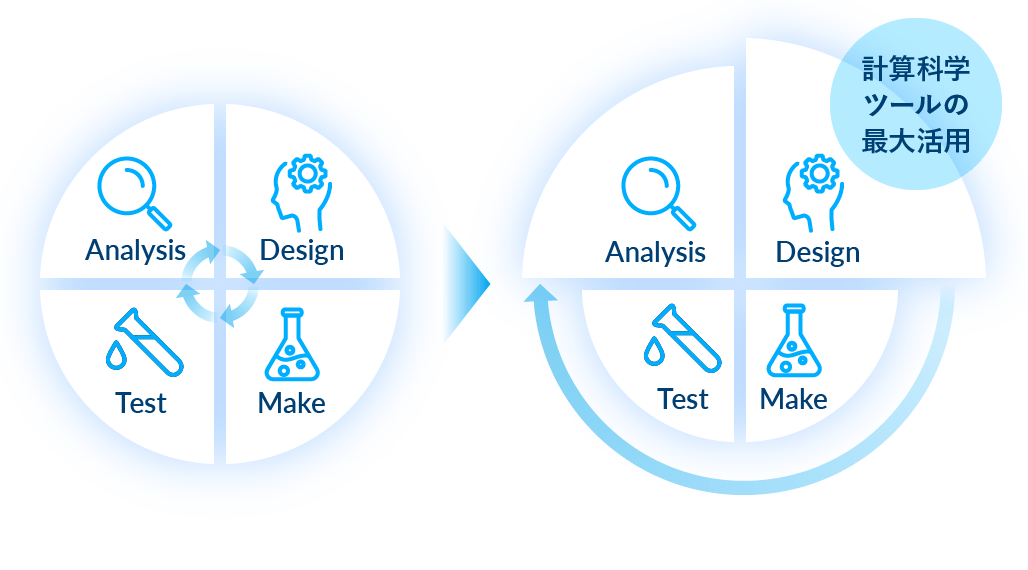
6 化合物最適化
化合物設計・合成を可視化したマップで、活性の強さや物性の良否を評価しています。「設計(Design)→合成(Make)→評価(Test)→分析(Analysis)」というサイクルのうち、AI予測を活用して、特に「設計」の部分を充実させることによって、無駄な合成を削減し、期間短縮を図っていきます。重要な評価データは次の設計に活かし、効率的合成には自動合成機も導入。計算科学と実験の連携によりDMTAサイクルを効率化し、創薬のさらなるスピードアップを目指しています。